はじめに
まず、抗体医薬品の魅力は何でしょうか? 幾つか上げると、①生体高分子であることから医薬品として生体が受け入れ易く、血中半減期が長い。②高い親和性と特異性を有する分子標的薬である。③創薬シナリオ(TPP)が描きやすい。④多くの技術開発と開発実績により開発ノウハウが蓄積されている。⑤抗体創薬の魅力を最大化する特徴として、結合部位が2価であることである。つまりそれぞれが異なるエピトープに結合する特徴を有するBi-specific抗体の開発が着目されている。一方欠点としては、大きな分子量とヘテロ4量体という複雑な構造に起因する製造工程・コストや標的へのアクセスにおける課題は残っている。
標的分子に対して様々な結合部位に対して幾つもの抗体が取得できる。しかし、臨床応用の目的によって、すべての抗体が有効な訳ではなく、最適の抗体をスクリーニングするプロセスが重要である。我々は、これを『Epitope(エピトープ)創薬』と呼んでいる。例として中和活性の場合は理解しやすい。リガンド・受容体反応における標的分子の生理機能を抑制するには、標的のどこに結合するのが良いのか、直接リガンド受容体の結合部位にで競合阻害する他にも、立体障害やアロステリックな構造変化を誘導することでリガンド・受容体の結合阻害を誘導できる。どのエピトープを選択するかで製品特性が異なってくる。また生理作用を誘導するアゴニスト抗体の創出も可能であるが、アゴニスト活性を誘導できるエピトープの選択には時間を要する。VHHは通常の抗体の1/10程度の分子量であり、そのエピトープの特徴も従来の抗体とは異なり、従来の抗体に比べてエピトープの多様性は大きい。結果として、VHHは新たなMOAによる医薬品創出の可能性が大きい。
もう一点、これからの創薬で注目されるのが、『Paratopic(パラトピック)創薬』である。これは、一つの標的分子に対して複数の部位に結合する薬剤の開発である。従来の抗体では、Bi-specific抗体技術が注目されているが、これは別々の標的に対して同時に結合する抗体分子の創出が主である。一方、VHHは分子量が小さいので同一の標的分子の別々のエピトープに同時に結合する分子を設計することが可能であり、親和性と特性性を増強できるだけでなく、別々の機能ドメインを同時に阻害できるため、機能も向上することが知られている。そして変異が発生して体制を生じ易い標的に好都合であり、VHH創薬では複数のVHHを連結することで(多価化と呼ぶ)製剤化されることが多い。
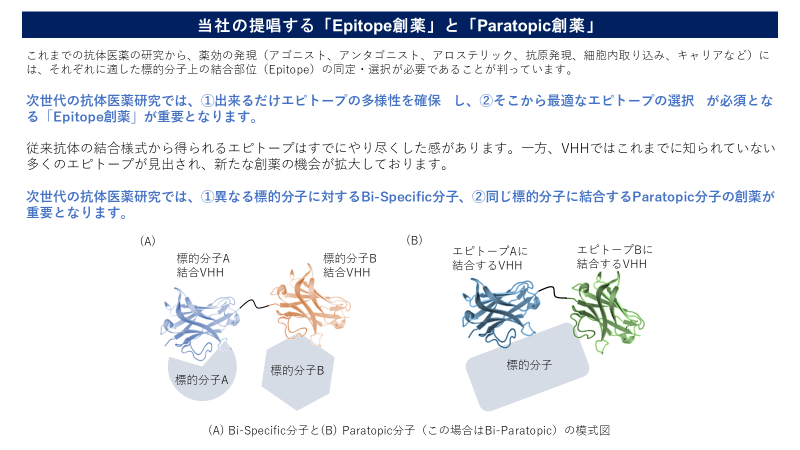
つまり、以上述べたように、抗体創薬では様々なエピトープに結合する抗体を幅広く取得し、目的の薬効を最大に引き出すエピトープを同定することが成功のカギである。VHHライブラリーからのスクリーニングでは、如何に多様なVHHを取得し、多価化の分子デザインによって、これまでにない新しい抗体分子の創出が期待される。
1.VHHの発見(歴史)
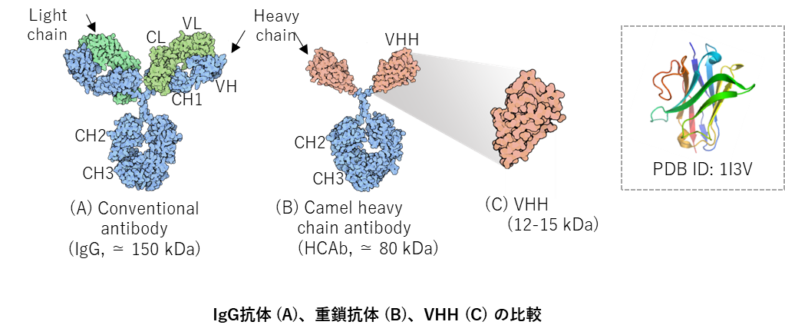
アルパカ(Vicugna pacos)やリャマ(Lama glama)などのラクダ科動物の血液中には、2つの重鎖(H鎖)と軽鎖(L鎖)で構成されるIgG抗体の他に、約20~40%の割合で重鎖のみで構成される抗体(重鎖抗体; HCAb)存在することが報告された。重鎖抗体では軽鎖とのヘテロダイマーを形成しないため、重鎖定常領域のCH1ドメインが欠失している。IgG抗体におけるVHーVL間の疎水性相互作用が無いために、通常は分子内に埋もれているアミノ酸残基が表面に露出するために、幾つかのポジションにおいて親水的なアミノ酸(ホールマークと呼ばれる)への置換が観察される。HCAbの可変領域がVHH、またはシングルドメイン抗体と呼ばれています。その分子量は12-15 kDaで、IgG抗体(約150 kDa)、Fab 断片(約50 kDa)、一本鎖抗体scFv(約25 kDa)と比較しても小さく、抗体工学技術を応用した医薬品への応用が期待されます。
2.なぜVHHが次世代抗体として期待されるのか
まず物理化学的性質では、分子量は1.3-1.5KD程度で、Tm値も高く、変性後のリフォールディングが容易である。そのため、大腸菌などの宿主で大量調製が容易で製造のコストダウンが図れる。室温での安定な保存や輸送が可能であり、薬剤管理のコストダウンも期待できる。つまり、グローバル市場にて、医療経済の改善と、医療費が困窮している地域医療にも薬剤提供が広がると期待されている。
また、製剤設計の側面からは、注射剤の他に、経肺、経鼻などが検討されており、最近では経口によって大腸粘液まで到達して炎症を抑制するVHHも報告されている。特に注目されるのがBBB透過のVHHの取得で、今後の様々な利用が期待されている。

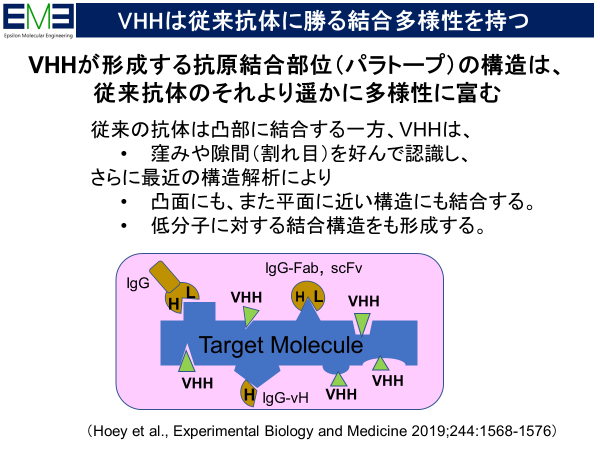
創薬の観点では、結合様式が多様であることがポイントとなる。特に標的分子の構造上の窪みや割目を好んで認識することである。例えば、複数膜貫通タンパクを標的にした場合を考えよう。細胞外に露出する部分は少なく、従来の抗体が結合できるエピトープは少ない。一方、幅広いエピトープ構造を認識できるVHHは取得可能である。
3.VHHのCDR3の構造特性
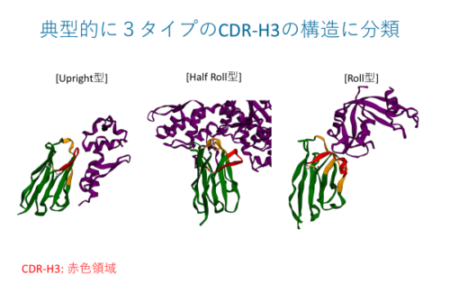
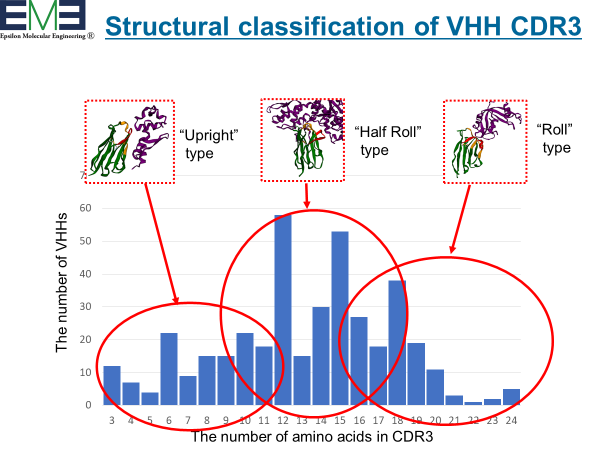
VHHが形成する抗原結合部位(パラトープ)の構造は、従来の抗体(IgG抗体)のそれより遥かに多様性に富むことが報告されている。つまり、従来の抗体は抗原の凸部を好んで結合する一方、VHHは窪みや隙間(割れ目)を好む。それはH鎖CDR3がペプチドアプタマー様に結合できるためである。VHHは様々のタンパク質との複合体として結晶構造解析が実施され、400近いVHHの構造がデータベースに登録されている。
我々は、VHH抗体の結合モードの特徴を探るためにこのデータベースを解析した。すると、CDR3の結合は主に3タイプに分類できることが判った。さらに、これら構造分類はCDR3の長さに依存していることを見出した。こうした構造特性は、人工VHHライブラリーの設計に大変に重要な情報を提供してくれる。我々は現在、この情報を活用してヒト化人工ライブラリーとしてPharmaLogical Libraryを構築した。世界各地で様々のVHHライブラリが構築されているが、効率的なライブラリースクリーニング法との組み合わせによって速やかにVHHが取得できる時代になっている。今後、VHH創薬研究はますます加速され、従来抗体市場に置き換わる日もそう遠い話ではばいであろう。
4.創薬応用のひろがり
- 1. 多価の結合部位による創薬(multi-spec VHHs, multi-paratopic VHHs etc)
- 2. アロステリック作用による創薬
- 3. アゴニスト作用による創薬
- 4. Targeting VHHによる創薬
ADC/光免疫/イメージング診断 - 5. 細部内標的の創薬(Intrabody)
- 6. 細胞治療・遺伝子治療法への活用
1.多価化が可能
VHHはエンジニアリングしやすいドメイン構造を有するため、複数のVHHをペプチドリンカー(GS)で結合することが出来る。ホモダイマーの他、ヘテロダイマー、トライマーなどが臨床開発にて評価中である。特に遺伝子変異の頻度が高い抗原に対しては、複数の結合部位に結合することで薬剤耐性を回避することが期待されている。
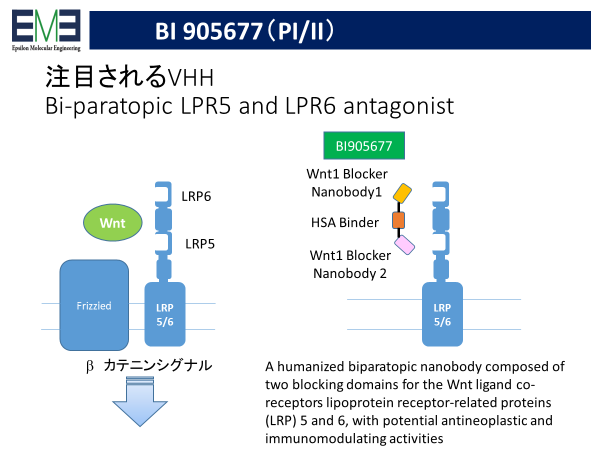
また、標的に分子に複数の機能ドメインがある場合、それぞれに対するVHHを連結することで、優れた薬効が発揮されている。上図の通り、BI905677はLPR5およびLPR6を同時に阻害することで高い有効性を示している。なお、血中半減期を確保するためにHSAに対するVHHを付加するのが一般的になっている。
2.アロステリック作用の誘導
通常の抗体でも結合によって標的分子の構造変化を誘導して機能する場合がある。VHHはその結合特性から、例えば、標的分子のドメイン間の隙間に滑り込んで大きな構造変化を誘導した結果、EGF受容体の相互作用を阻害するものが取得されている。標的分子の機能阻害においては、直接活性ドメインを阻害するアプローチが一般的ではあるが、アロステリックな作用点を見出すことで新たな創薬が可能となる。
3.アゴニスト抗体
受容体の2量体誘導など抗体によるアゴニスト活性の誘導は良く知られている。
VHHも多価化することでアゴニスト活性を誘導することが出来る。従来の抗体に比べて分子量が1/10と小さいので、立体障害が少なく、より非活性の高いアゴニストを創薬できる。
がん治療領域でも、免疫チェックポイント分子に対する様々なアゴニスト抗体が作成され、臨床段階に進んだものもある。今後、VHHアゴニストの開発も加速してくると予想する。
4.Targetingとして活用
VHHは従来型抗体に比べて約1/10程度の分子量である。従って、組織移行性、標的分子への移行性が優れている。VHHは腎臓排泄のため血中半減期はせいぜい40分程度と短い。そのため、診断・イメージングにおいてはバックグランドが小さく、鮮明な画像診断が実施できる。多くの診断・イメージングへの応用が急速に進んでいる。また、治療領域でも、ADCや光免疫療法への応用が進められている。最近、BBBを透過するVHHが単離されたことで脳・神経系疾患の治療薬開発に期待が高まっている。
5.Intrabody
近年中分子創薬が脚光を浴びているが、その多くの標的分子は細胞内分子である。VHHは従来抗体に比べて細胞内で再構成・機能させることが可能である。細胞内環境(還元状態)でしっかり機能するVHHを取得することで、効果的な細胞内抗体を創薬することが可能である。我々が所有するcDNA Display Screening法は様々な環境下にある標的分子に対するVHHを取得することが出来、現在、細胞内抗体医薬品の開発技術の構築に取り組んでいる。次項で取り上げる遺伝子治療における機能分子として細胞内VHH医薬は、今後の医薬品開発の柱となることは間違いない。
6.細胞・遺伝子治療への応用
AAVベクターによる遺伝子治療法の開発が進んでいるが、標的細胞への特異性の改善が求められてる。我々は、VHHをDDSに活用した改変AAVベクターを開発した(特許出願中)。標的細胞に特異的に結合するVHHを自在に置き換えが可能なAAVベクターを開発したことで、がんや神経性疾患など臨床応用の可能性が大きく広る。我々は、上述の細胞内VHHと細胞標的VHHを併用するVHHダブルターゲティングの研究開発に取り組んでいる。
5.臨床開発の状況
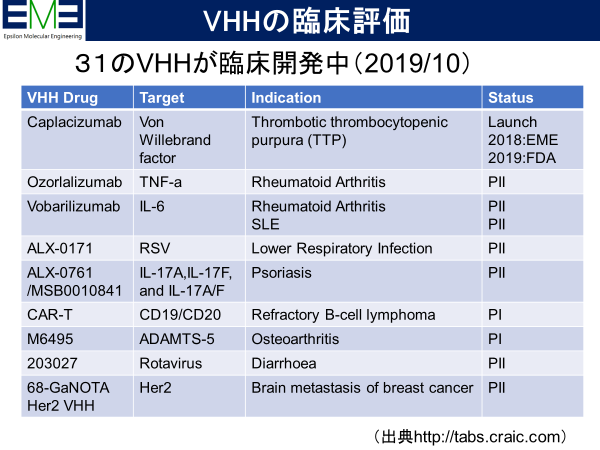
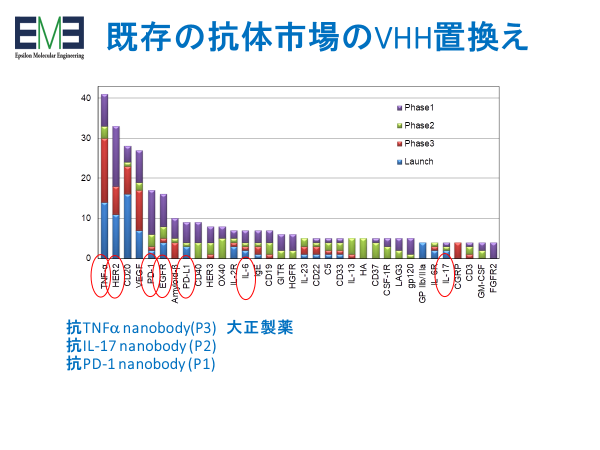
初のVHH医薬品Caplacizumabは2018年欧州で、2019年米国で承認された。1993年にその存在が発見されてから実に27年後である。これをきっかけにVHHが再度注目されたことは疑いはない。基本特許もすでに満了してるので参入障壁は大きくなく、ベンチャー企業や製薬企業が本格的にVHH創薬に取り組み始めた。現在のところ、従来型の抗体医薬を置き換えるタイプの薬剤開発が目立っている。
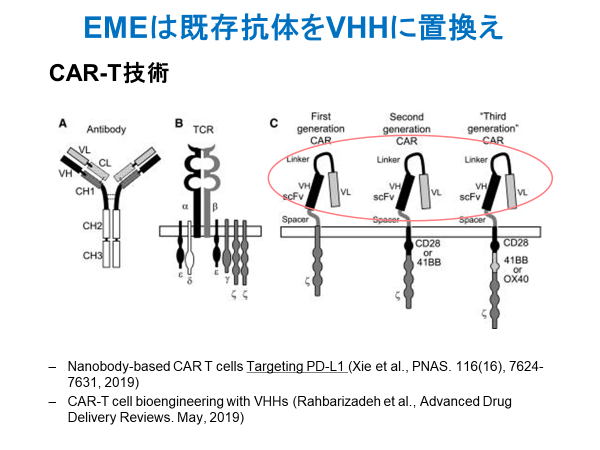
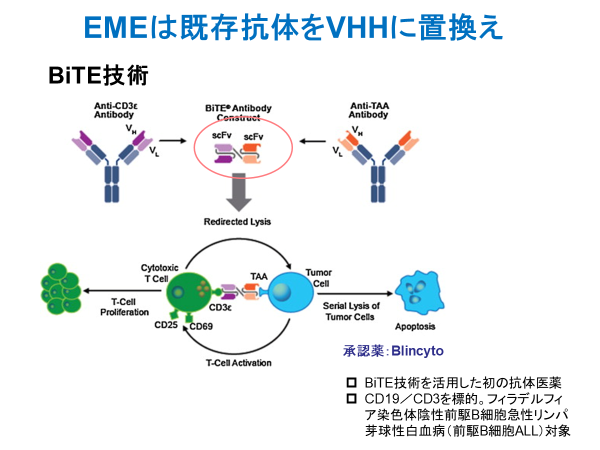
特に、従来抗体由来の一本鎖scFv抗体断片は不安定であることから、これを積極的に置き換える研究開発が進んでいる。その典型ががん免疫療法におけるCAR-T細胞治療で、様々なプログラムでscFvからVHHへの置換えが進んでいる。新規の標的分子については最初からVHHでの開発が進んでいる。また、Bispecific抗体医薬として知られるBiTE技術のよる製剤もVHHへの置換えが検討されている。
おわりに
世界でVHH創薬研究が盛んになってきた。1993年に発見されてからやっと次世代抗体の第一候補として注目されている。最近の動向を見ても、COVID-19に対する中和VHH抗体の取得が次々と報告され、その注目度の高さが伺える。我々もわずか一月でCOVID-19に対する中和VHHの取得に成功している。現在VHHライブラリーが次々に構築されており、ベンチャーと大手製薬の提携が相次いでいる。日本は、欧米・中国に遅れをとらぬよう早急にVHH創薬研究基盤の強化に取り組むべきである。

